Нобелевская премия по химии присуждена за развитие криоэлектронной микроскопии для определения структуры молекул с высоким разрешением в растворе

Как отмечается в пресс-релизе комитета, идображение исследуемого объекта часто является ключом к пониманию, и нНаучные прорывы часто основываются на успешной визуализации объектов, невидимых для человеческого глаза. Однако биохимические изображения были часто "пустыми", потому что доступная технология с не позволяла получить картинку многих молекулярных структур. Криоэлектронная микроскопия все изменила - теперь исследователи могут заморозить биомолекулы в середине фазы движения и визуализировать процессы, которые они ранее были доступны глазу. Это, по мнению комитета, явлилось решающим как для базового понимания химии жизни, так и для новых подходов к созданию фармацевтических препаратов.
Электронные микроскопы долго считались пригодными только для изображения мертвого вещества, поскольку мощный электронный пучок разрушает биологический материал. Но в 1990 году Ричарду Хендерсону удалось использовать электронный микроскоп для создания трехмерного изображения белка с атомным разрешением. Этот опыт стал прорывом, доказывающим возможность применения технологии для исследования живых молекуд.
Иоким Франк с 1975 по 1986 год разработал метод обработки изображений, в котором нечеткие двумерные изображения, полученные с помощью электронного микроскопа, анализируются и показывают трехмерную структуру изучаемых молекул.
Жак Дюбоше в начале 1980-х годов разработал метод заморозки, при котором создавалась мономолекулярная пленка, в которой молекулы образца сохраняли свою естественную форму.
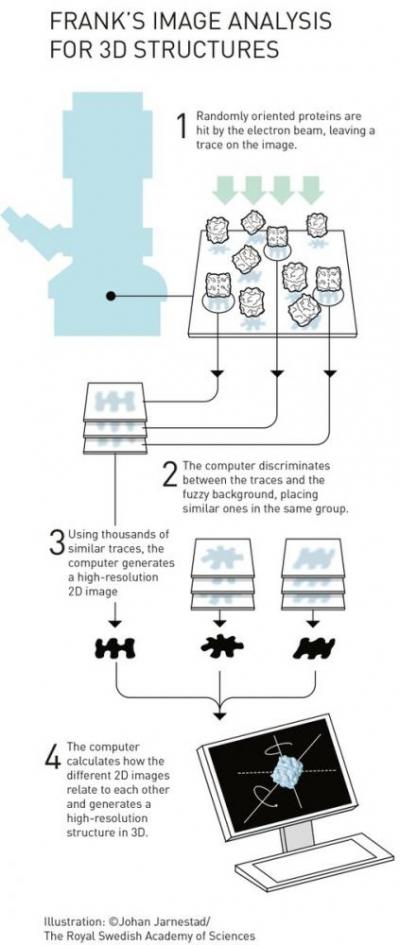
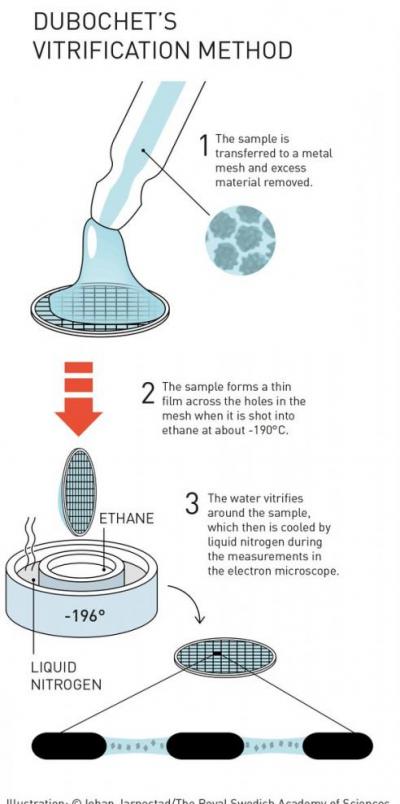
«После этих открытий каждая гайка и болт электронного микроскопа были оптимизированы. Желаемое разрешение атомов было достигнуто в 2013 году, и исследователи теперь могут регулярно получать трехмерные структуры биомолекул. За последние несколько лет научная литература была заполнена изображениями всего: от белков, которые вызывают устойчивость к антибиотикам, до поверхности вируса Зика. Теперь биохимия стоит на пороге взрывоопасного развития, и это все говорит об увлекательном будущем», - отмечается в пресс-релизе Нобелевского комитета.

- 18 апреля 2024 РЕДМЕТ-2024
- 25 марта 2024 В мире будет расти глобальная конкуренция за обладание редкоземельным сырьем — Андрей Шевченко
- 21 марта 2024 Ассоциация РМ и РЗМ и Национальная ассоциация производителей источников тока «РУСБАТ» заключили соглашение о сотрудничестве Новости 21 марта 2024
- 19 марта 2024 Руслан Димухамедов выступил на III отраслевой конференции «Редкие и редкоземельные металлы»
- 18 марта 2024 Журнал «Редкие земли» на заседании Горного совета Северо-Западного федерального округа
- 18 марта 2024 Горнорудный дивизион Росатома расширяет выпуск редкоземельной продукции. При участии СМЗ выплавлен первый слиток металлического тантала
- 15 марта 2024 Соликамск отметил день рождения магниевого завода
- 7 марта 2024 III Отраслевая конференция «Редкие и Редкоземельные металлы»
- 2 марта 2024 Владимир Путин поручил нацелить геологоразведку на поиск редкоземельных материалов и другого сырья для экономики
- 16 февраля 2024 Замминистра ответил на вопросы журнала Редкие земли
- 15 февраля 2024 Андрей Андрианов о запуске в России производства постоянных редкоземельных магнитов
- 15 февраля 2024 Ключевые успехи российской промышленности представили на выставке-форуме «Россия»
- 13 февраля 2024 Дойти до конца цепочки
- 12 февраля 2024 Журнал «Редкие земли» на Торжественном вечере, посвящённом 300-летию Российской академии наук
- 7 февраля 2024 «Нет ничего выше и прекраснее, чем давать счастье многим людям», — Людвиг ван Бетховен.

